Mga katangian ng pasyente, tumor, at paggamot
Ang mga pathological at klinikal na katangian ng mga lokal na advanced na pasyente ng kanser sa suso na sumasailalim sa neoadjuvant chemotherapy ay maaaring ibuod sa Talahanayan 1. Ang mga pasyente sa pag-aaral ay may average na edad na 51 taon. Ang mga pasyente ay nagpakita ng isang paunang average na laki ng tumor na 5.21 cm, na bumaba sa isang natitirang average na laki ng tumor na 2.70 cm kasunod ng paggamot. Sa lahat ng 174 na pasyente, 137 ang inuri bilang mga tumugon, at ang natitirang 37 ay itinalaga bilang mga hindi tumugon. Isinasaad ng histology na 91% ng mga pasyente ay na-diagnose na may Invasive Ductal Carcinoma, 3% ay may Invasive Lobular Carcinoma, at ang natitirang 6% ay may Invasive Mixed Carcinoma. Sa mga tuntunin ng grade ng tumor, 6% ng mga pasyente ay inuri bilang Grade I, 37% ay may Grade II na mga tumor, at 48% ay may Grade III na mga tumor, na ang mga labi ng 9% ay hindi naiulat. Bilang resulta ng systemic therapy, 42% ng mga pasyente ay sumailalim sa AC-T (Adriamycin, Cyclophosphamide, at Paclitaxel), 21% sa FEC-D (5-Fluorouracil, Epirubicin, Cyclophosphamide, at Docetaxel), at 37% sa iba pang mga regimen ng chemotherapy. Ang pagkakaiba sa tumor ay isinagawa gamit ang mga molekular na subtype, kabilang ang ERBB2 + (ER -, PR -, HER2 +), triple-negative (ER -, PR -, HER2 -), Luminal-A (ER + at/o PR +, HER2 – ), at Luminal-B (ER + at/o PR + , HER2 +). Sa loob ng responder cohort, ang pamamahagi ng mga molekular na subtype ay ang mga sumusunod: 15% ay inuri bilang ERBB2 +, 27% bilang triple negatibo, 32% bilang Luminal-A, at 26% bilang Luminal-B. Kabilang sa nonresponder cohort, ang pagkasira ng mga molekular na subtype ay ang mga sumusunod: 0% ay ikinategorya bilang ERBB2 +, 22% bilang triple negatibo, 65% bilang Luminal-A, at 14% bilang Luminal-B.
Dami ng ultrasound parametric na mga mapa
Ipinapakita ng Figure 1 ang mga QUS parametric na mapa ng ASD, AAC, MBF, SS, at SI na naka-overlay sa mga imahe ng ultrasound B-mode na nakuha mula sa kinatawan na hindi tumutugon at tumutugon sa mga pasyente sa pretreatment. Ang isang tumor sa isang B-mode na imahe ng dibdib ng pasyente ng LABC ay madaling matukoy bilang isang hypo-intense na masa na napapalibutan ng medyo hyper-intense na fibroglandular tissue. Ang mga parametric na mapa ng ASD, AAC, MBF, SS, at SI ay nagtataglay ng karagdagang impormasyon tungkol sa tumor, sa bawat rehiyon (core at margin) na naglalaman ng natatanging pattern ng textural.
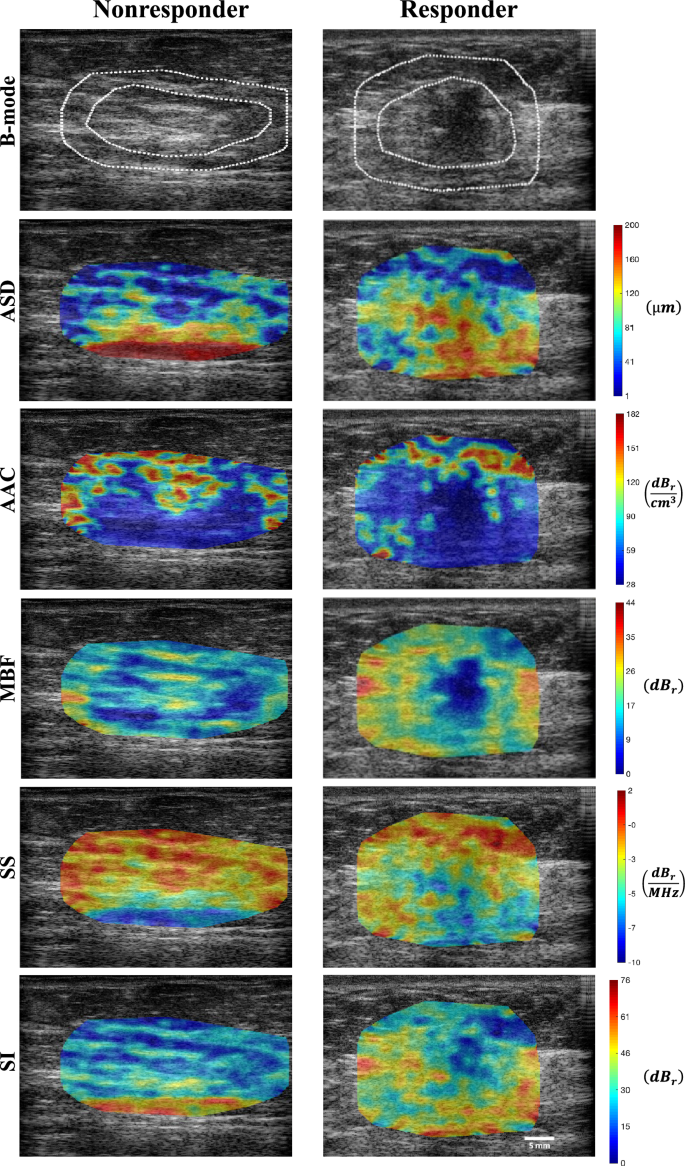
Kinatawan ng B-mode, ASD, AAC, MBF, SS at SI parametric na mga imahe na may tumor core at margin na mga rehiyon ng isang hindi tumutugon at isang tumutugon sa pretreatment. Ang mga color bar ay nagpapahiwatig ng mga halaga ng kaukulang mga parameter sa mga rehiyon ng tumor, bawat isa ay ipinahayag sa pamamagitan ng kaukulang yunit nito. Ang puting scale bar ay kumakatawan sa 5 mm.
Pagganap ng pag-uuri
Ipinapakita ng Figure 2 ang mga confusion matrice ng hula sa pagtugon sa hindi nakikitang dataset. Para sa spectral slope, ang binuo na modelo ay may kakayahang ganap na mahulaan ang lahat ng mga tumutugon. Sa pitong hindi tumutugon, lima ang tumpak na hinulaang.
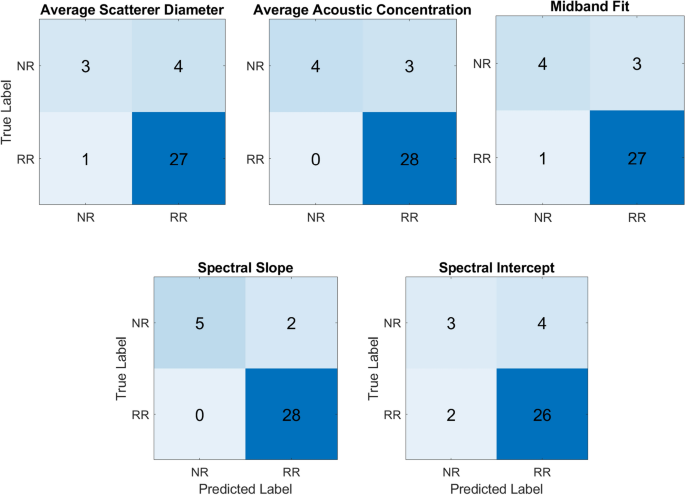
Confusion matrice ng hula sa pagtugon sa hindi nakikitang dataset.
Ipinapakita ng talahanayan 2 ang mga resulta ng hula ng tugon sa hindi nakikitang dataset. Sa lahat ng QUS parametric na mga imahe, ang modelong binuo batay sa spectral slope parametric na mga imahe ay gumanap ng pinakamahusay sa paghula ng tugon bago ang paggamot na may, precision, recall, at F1-score na 100%, 71%, 83%, 93%, 100%, at 97% para sa hindi tumutugon at tumutugon na mga pasyente, ayon sa pagkakabanggit. Nakamit ng pangkalahatang katumpakan ng iminungkahing modelo ang katumpakan na 86% sa hindi nakikitang dataset.
Survival curves
Ang pangkalahatang survival at recurrence free survival curves para sa dalawang grupo ng pasyente batay sa clinical at pathological criteria ay ipinapakita sa Fig. 3. Ang limang taong survival rate para sa mga responder at nonresponder ay 96% at 88%, ayon sa pagkakabanggit. Sa mga tuntunin ng walang pag-ulit na kaligtasan ng buhay, ang mga tumutugon ay nagpapakita ng isang rate ng 91%, habang ang mga hindi tumutugon ay nagpapakita ng isang mas mababang rate ng 82%. Ang mga pagkakaiba sa pagitan ng dalawang pangkat ng pagtugon ay makabuluhan ayon sa istatistika (\(p<0.05\)).
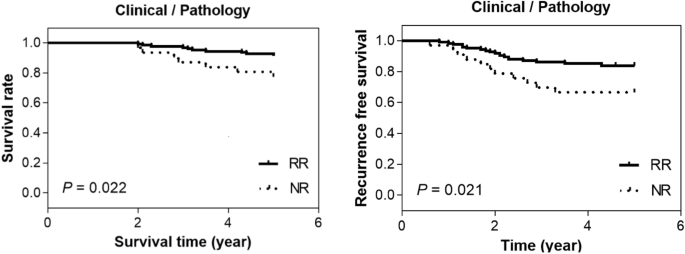
Pangkalahatang kaligtasan ng buhay at pag-ulit ng libreng survival curves para sa dalawang pangkat ng pasyente batay sa klinikal at pathological na pamantayan.
Pagtalakay at konklusyon
Ang pag-aaral na ito ay nag-imbestiga ng isang nobelang transfer learning-based na diskarte para sa paghula ng LABC na tugon sa neoadjuvant chemotherapy gamit ang QUS imaging sa pre-treatment. Ang ground truth response sa therapy para sa bawat pasyente ay nakabatay sa standard clinical at pathological criteria. Ang ResNet50V2 deep learning architecture ay ginamit upang kunin ang mga feature mula sa mga parametric na mapa. Sinundan ito ng SelectKBest at SMOTE na mga diskarte para sa pagpili ng tampok at pagbabalanse ng data, ayon sa pagkakabanggit. Ang algorithm ng SVM ay ginamit upang ikategorya ang mga pasyente sa dalawang natatanging grupo: mga tumutugon at hindi tumutugon. Ang binuo na modelo ay nasuri gamit ang apat na sukatan ng pagganap sa hindi nakikitang dataset. Kabilang dito ang precision, recall, F1-score, at balanseng katumpakan. Ang mga resulta ng transfer learning-based na diskarte sa isang hindi nakikitang dataset ay nagpakita na ang spectral slope parametric na mga mapa ay gumanap ng pinakamahusay sa paghula ng tugon, na may katumpakan, recall, at F1-score na 100%, 71%, 83%, 93%, 100% , at 97% para sa hindi tumutugon at tumutugon na mga pasyente, ayon sa pagkakabanggit. Ang balanseng katumpakan ng iminungkahing modelo ay 86%.
Ito ay na-hypothesize na ang QUS-detected na mga tugon sa mga tumor sa cancer therapy ay nauugnay sa mga biological na pagbabago sa tumor microstructure at spatial heterogeneity. Ito ay humantong sa ilang mga preclinical at clinical QUS na pag-aaral na isinagawa upang makita ang pagtugon ng tumor sa paggamot nang maaga at sa panahon ng paggamot.7,13,14. Sa mga pag-aaral na ito, ang mga parameter ng QUS spectral tulad ng MBF, SS, at SI ay nagpakita ng isang makabuluhang ugnayan sa tugon ng tumor sa paggamot. Ang mga spectral na parameter na ito ay nauugnay sa mga katangian ng scatterer, tulad ng laki ng scatterer at scatterer acoustic concentration15. Katulad nito, ang ASD at AAC, na tinatantya mula sa ultrasound backscatter coefficient sa pamamagitan ng paglalagay ng isang spherical Gaussian na modelo sa sinusukat na backscatter coefficient, ay ginamit upang masubaybayan ang pagtugon ng tumor sa mga pasyente ng LABC na sumasailalim sa NAC15. Bukod dito, ang mga tampok na textural na tinutukoy mula sa QUS parametric na mga mapa, tulad ng kaibahan, ugnayan, enerhiya, at homogeneity ay ipinakita upang mahulaan ang tugon sa paggamot sa tumor sa mga pasyente ng kanser sa suso.11,14. Sa mga pag-aaral na ito, ang mga feature na manu-manong na-engineered, tulad ng mga feature na istatistika at textural ng mga parametric na mapa ng QUS, ay kinuha at ginamit para sa paghula ng tugon gamit ang mga nakasanayang diskarte sa pag-aaral ng makina. Bagama’t ang proseso ng manu-manong pagkuha ng naturang mga tampok ay simple, mas madaling maunawaan at pag-aralan, mayroon itong sariling mga kakulangan. Una, ito ay madalas na nangangailangan ng intuwisyon ng tao at kadalubhasaan sa domain, na maaaring magtagal. Bilang karagdagan, ang mga manu-manong na-engineered na feature ay madalas na nangangailangan ng pag-customize para sa mga partikular na dataset at maaaring hindi maisa-generalize nang maayos. Ang Convolutional Neural Networks, sa kabilang banda, ay natututo ng mga feature nang direkta mula sa mga larawan, na nagbibigay-daan sa kanila na makakuha ng mahalagang impormasyon para sa partikular na gawain, gaya ng paghula sa pagtugon sa paggamot. Bukod dito, natututo ang mga CNN ng hierarchical na representasyon ng data. Sa pamamagitan ng maraming antas ng abstraction, awtomatiko nilang natutuklasan at kinakatawan ang parehong mababang antas at mataas na antas ng mga katangian ng imahe. Ang kakayahang matuto ng mga kumplikadong representasyon ay nagbibigay-daan sa mga CNN na makuha ang masalimuot na mga pattern at relasyon sa mga larawan, na kadalasang nagreresulta sa mas mataas na katumpakan.
Sa isang kamakailang pag-aaral, Taleghamar et al.7 gumamit ng malalim na modelo ng pag-aaral upang mahulaan ang pagtugon ng tumor sa paggamot sa mga pasyenteng may kanser sa suso gamit ang QUS bago ang paggamot. Iba’t ibang convolutional neural network architecture ang ginamit upang kunin ang mga feature mula sa QUS parametric na mga mapa. Ang isang ganap na konektadong network ay ginamit para sa paghula ng tugon sa paggamot. Nakamit ng kanilang mga binuo na modelo ang katumpakan na 88% sa isang hindi nakikitang dataset. Gayunpaman, ang kanilang diskarte ay mahal sa pagkalkula at nangangailangan ng malaking halaga ng mga larawang may label para sa pagsasanay na ginagawang hindi kanais-nais para sa kasalukuyang problema. Nag-aalok ang transfer learning ng maraming pakinabang kaysa sa tradisyonal na malalim na pag-aaral dahil binibigyang-daan nito ang paggamit ng mga modelong nasanay na sa malalaking dataset. Sa pamamagitan ng pagsisimula sa mga pre-trained na modelo, ang oras ng pagsasanay at mga mapagkukunan ay maaaring makabuluhang bawasan. Bukod dito, nangangailangan lamang ito ng maliit at may label na dataset, dahil natutunan na ng pre-trained na modelo ang mga generic na feature. Sa gawaing ito, ang mas mababang mga layer ng ResNet50 ay ginamit upang makuha ang mga generic na tampok mula sa mga mapa ng QUS, habang ang mas mataas na mga layer ay pinalitan ng SVM classifier upang mahulaan ang tugon sa paggamot ng mga pasyente ng kanser sa suso (Fig. 4).
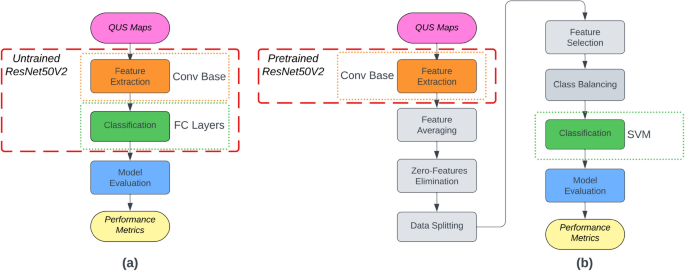
(a) Tradisyunal na malalim na pag-aaral na pag-uuri ng imahe (b) Iminungkahing diskarte gamit ang transfer learning.
Kabilang sa iba’t ibang magagamit na mga arkitektura sa mga application ng computer vision, ang ResNet ay pinili para sa feature extraction dahil gumagamit ito ng mga skip connection na nagbibigay-daan para sa mas malalim na mga arkitektura kaysa sa conventional CNNs. Ang mga mas malalalim na network ay maaaring makakuha ng mas masalimuot na feature at matuto ng higit pang abstract na mga representasyon, na magreresulta sa pinahusay na pagganap sa mahihirap na gawain tulad ng hula sa pagtugon sa tumor. Mula sa pamilya ng ResNet ng mga pre-trained na modelo (tulad ng ResNet50V2, ResNet101V2, at ResNet152V2), ginamit ang ResNet50V2 dahil maliit ang sukat nito (50 layers) at samakatuwid ay may mas mahusay na mga kakayahan sa generalization at mas mababang panganib ng overfitting kung ihahambing sa iba mga pre-trained na modelo ng pamilya ng ResNet.
Ang Precision (tinatawag ding Positive Predictive Value o PPV) ay sumusukat sa proporsyon ng mga tamang inuri na positibong pagkakataon mula sa kabuuang mga pagkakataong hinulaang positibo. Ito ay isang sukatan ng kakayahan ng classifier na maiwasan ang mga maling positibo. Ang Recall (tinatawag ding Sensitivity o True Positive Rate) ay sumusukat sa proporsyon ng wastong inuri-uri na mga positibong pagkakataon mula sa kabuuang aktwal na positibong mga pagkakataon. Ito ay isang sukatan ng kakayahan ng classifier na kumuha ng mga positibong pagkakataon. Ang F1-score ay ang harmonic mean ng precision at recall. Nagbibigay ito ng balanseng pagsukat na nagsasama ng parehong sukatan at partikular na kapaki-pakinabang kapag may hindi balanse sa pagitan ng positibo at negatibong mga pangyayari gaya ng sa dataset na ito. Kinakalkula ng balanseng katumpakan ang ibig sabihin ng mga katumpakan sa bawat klase habang isinasaalang-alang ang kawalan ng timbang sa mga laki ng klase. Nagbibigay ito ng pangkalahatang pagsukat ng bisa ng classifier sa lahat ng klase. Dahil partikular kaming nakatuon sa pagtukoy sa mga hindi tumutugon, ang isang positibong kaso ay nagpapahiwatig na ang pasyente ay nabibilang sa kategoryang hindi tumutugon. Ang iminungkahing modelo ay may katumpakan, recall, F1-score, at Balanseng Katumpakan na 100%, 71%, 83%, at 86%, ayon sa pagkakabanggit gamit ang mga SS parametric na mapa. Ipinapahiwatig nito na ang diskarteng ito ay may 71% na posibilidad na mahulaan ang isang hindi tumutugon na pasyente habang iniiwasan ang maling pag-uuri ng mga tumutugon na pasyente bilang mga hindi tumutugon. Ito ay mahalaga upang matiyak na ang chemotherapeutic treatment regimen ay ibinibigay sa lahat ng potensyal na tumutugon sa mga pasyente. Kapag nakikitungo sa hindi balanseng data, ang sukatan ng pagganap ng F1-score ay madalas na itinuturing na mas mataas kaysa sa katumpakan. Sa pag-aaral na ito, ang klase ng mga tumutugon (137) ay mas marami kaysa sa klase ng mga hindi tumutugon (37), kaya posible na makakuha ng mataas na antas ng katumpakan sa pamamagitan lamang ng paghula sa karamihan ng klase (mga tumutugon) para sa lahat ng pagkakataon. Gayunpaman, maaari itong magresulta sa kawalan ng kakayahang matukoy nang tama ang mga pagkakataon ng klase ng minorya (mga hindi tumutugon). Ang hindi wastong paghula sa mga hindi tumutugon, ay nagpapahiwatig ng pangangasiwa ng isang hindi kinakailangang paggamot na maaaring humantong sa mga napalampas na pagkakataon upang mapahusay ang mga resulta ng kalusugan.
Ang karagdagang pagsusuri ng mas malalaking dataset, na pinag-stratified ng iba’t ibang regimen ng NAC at posibleng iba’t ibang molekular na subtype, ay maaaring magresulta sa mas tumpak na mga predictive na modelo. Ang iminungkahing modelo ay maaari ring mapadali ang mga random na klinikal na pagsubok na naggalugad sa mga pagbabago sa regimen ng NAC para sa mga pasyente na may mababang posibilidad na tumugon sa mga karaniwang interbensyon. Sa konklusyon, ang pagsisiyasat na ito ay nagpapakita ng kakayahang umangkop ng paglipat ng pag-aaral para sa paghula ng tugon sa therapy gamit ang quantitative imaging sa pretreatment. Ang devised transfer learning model ay tumpak na hinuhulaan ang tugon ng mga pasyenteng may locally advanced na breast cancer sa NAC. Ang hula ng tugon ng NAC bago ang paggamot ay maaaring makatulong sa mga clinician sa pag-customize ng mga hindi epektibong regimen ng paggamot para sa mga indibidwal na pasyente. Ang mga nakapagpapatibay na resultang ito ay nag-uudyok sa karagdagang pagsisiyasat ng mga alternatibong arkitektura ng pag-aaral ng paglilipat at mas malaki, multi-institutional na mga cohort ng pasyente upang suriin ang katatagan ng mga pamamaraang ito sa mga klinikal na setting.


